اشباه اللافلزات لها خواص فيزيائية وكيميائية مشابهة للفلزات فقط

اشباه اللافلزات لها خواص فيزيائية وكيميائية مشابهة للفلزات فقط
علم الكيمياء يهتم كثيراً بالتعرف على مختلف العناصر في الطبيعة والسلوك وكيفية التفاعل مع باقي العناصر والتعرف عل أوجه الشبه والاختلاف من خلال المقارنات..
أشباه اللافلزات لها خواص فيزيائية وكيميائية مشابهة للفلزات فقط هذه العبارة خاطئة، لأن أباه الفلزات تتسمي بهذا الاسم لأنها لديها العديد من الخصائص المشتركة بين الفلزات واللافلزات ومن أمثلتها البورون والسيليكون والزرنيخ والجرمانيوم والأنتيمون والتيلوريوم.
تعريف أشباه الفلزات
أشباه الفلزات Metalloids، وهي عبارة عن مواد كيميائية لديها خصائص فلزية ولا فلزية، حيث إنها تعتبر من المواد الوسطية التي لا تضم عنصر محدد يجعلها تنضم إلى مجموعة محددة، وهذا يعني أنه لا يمكن اعتبارها من العناصر الفلزية بشكل كامل، ولا يمكن اعتبارها من العناصر اللافلزية بشكل كامل، ومن الجير بالذكر أنها تتواجد في الجدول الدوري على هيئة خط مائل تبدأ من عنصر البورون وعنصر الألومنيوم إلى أن تصل إلى عنصر البولونيوم وعنصر الأستاتسن.
عدد أشباه الفلزات
تتواجد أشباه الفلزات بين المجمعة الثالثة عشر والمجموعة السادسة عشر في الجدول الدوري، كما أن عددها يكون ثمانية عناصر رئيسية تترتب بشكل تصاعدي، ويمكن توضيحهم فيما يلي:
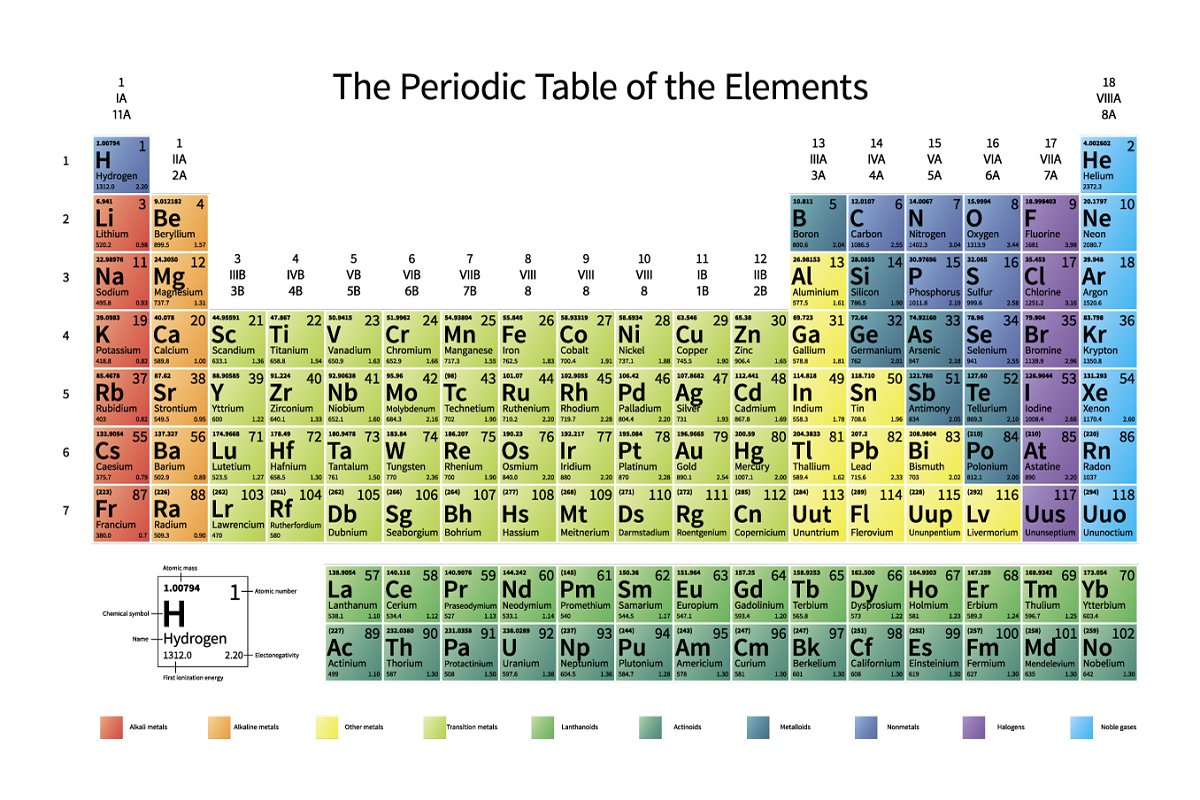
- عنصر البورون (B): يتواجد في المجموعة الثالثة وعدده الذري 5.
- السيليكون (Si): يتواجد في المجموعة الرابعة عشر في الجدول الدوري، وعدده الذري 14.
- الجرمانيون(Ge): يتواجد في المجموعة الرابعة عشر وعدده الذري 32.
- الزرنيخ (As): يقع في المجموعة الخامسة عشر وعدده الذري 33.
- الأنتيمون(Sb): يتواجد في المجموعة الخامسة عشر في الجدول الدوري، وعدده الذري 51.
- التيريليوم (Te): يقع في المجموعة السادسة عشر، وعدده الذري 52.
- البولونيوم(Po): يتواجد في المجموعة السادسة عشر في الجدول الدوري، وعدده الذري 84.
- التينيسين (Ts): يتواجد في المجموعة السابعة عشر في الجدول الدوري، عدده الذري 117.
خصائص أشباه الفلزات
تمتلك أشباه الفلزات العديد من الخصائص كونها تجمع بين الفلزات في شكلها الخارجي وتتصرف في العديد من الظروف مثل اللافلزات، ومن هذه الخصائص ما يلي:
- البريق الذي يتراوح بين اللمعان والبهتان.
- تتميز بالصلابة.
- بها شيء من المرونة، حيث يمكن تشكيلها بشكل مسطح.
- الهشاشة المختلفة بين بعض المواد، حيث إن بعض المواد تتميز بالهشاشة والبعض الأخر يتميز بالصلابة.
- متوسطة في توصيل الحرارة والكهرباء، حيث إنها تتراوح بين الفلزات واللافلزات.
- الاختلاف في درجات الحرارة.
- الاختلاف في درجات الانصهار.
- الاختلاف في الكثافة.
- تكون أشباه الفلزات قابلة للأكسدة.
- تدخل يف تكوين السبائك المعدنية عندما تتأكسد مع المعادن المختلفة.
- لها العديد من الأشكال البلورية.
- تنقبض عند الذوبان.
- لديها القدرة على تكوين المركبات عند تفاعلها مع الهالوجينات.
أماكن تواجد أشباه الفلزات
تتواجد أشباه الفلزات في العديد من الأماكن ومن هذه الأماكن مايلي:
- يتواجد عنصر السيليكون (Si) في القشرة الأرضية.
- يتواجد عنصر التيريليوم (Te) وعنصر الجرمانيوم (Ge) في التربة.
- يتواجد في جسم الإنسان عدد من أشباه الفلزات التي تنتقل عن طريق الطعام أو المحاصيل الزراعية عند تناولها.
استخدامات أشباه الفلزات
العناصر التى تنضم في قائمة اللافلزات يكون لديه العديد من الاستخدامات التى تدخل في عدد كبير من الأاشياء في حياتنا اليومية، وتكون الاستخدمات مختلفة على حسب العنصر، ومنها ما يلي:
- استخدامات السيليكون (Si): يدخل السيليكون في صناعة العوازل الكهربائية، وموانع الصدأ، ومُلطف الأقمشة، وبخاخ الشعر، وكريمات اليد، والأثاث، والمواد اللاصقة، كما أنه يُستخدم كمواد شبه موصلة في الكهرباء، وفي الرقائق الحاسوبية وهي عبارة عن شريحة صغيرة من السليكون النقي، ومن خلال هذه الرقائق تجري العديد من العمليات المُعقدة في ثوانٍ معدودة.
- استخدامات الزرنيخ (ِAs): يدخل الزرنيخ في الحصول على اللون البرونزي، حتى يقوم بتحسين صلابة المواد، وحتى تزداد كروية القذائف البندقية، بالإضافة إلى استخدامه في الترانزستور.
- استخدامات الجرمانيوم (Ge): يدخل في صناعة الترانستور وبعض الأجهزة الخلايا الضوئية، كما أنه يدخل في صناعة الأجهزة الإلكترونية من خلال عملية التطعيم والتي تقوم من خلالها إذابة الجرمانيوم ومن ثم يتم إضافة الزرنيخ حتى تتغير بعض الصفات الكيميائية، بالإضافة إلى أنه يدخل في صناعة السبائك ومصابيح الفلورسنت.
- استخدامات البورون (B): يمكن استخدام البورون غير المتبلور كمادة قابلة لإشعال الصواريخ، حيث إنها تعطي لون أخضر عند توهجها في الألعاب النارية، كما أنها تُستخدم في صناعة زجاج البايركس، حيث إنها تعمل على إضافة الصلابة غلى الزجاج ويجعله مقاوم إلى الحرارة.
- استخدامات الإثمد (Sb): يدخل الغثمد في العديد من الصناعات الإلكترونية مثل الصمامات الثنائية وكاشفات الأشعة تحت الحمراء، بالإضافة إلى أنه يتم خلطه مع الرصاص حتى تتحسن صلابتها، كما أنه يستخدم في تغليف الكابلات.
- استخدامات التيليريوم (Te): التيليريوم من أشباه الموصلات ولكن يميل إلى كونه موصل للكهرباء عندما يتعرض إلى ظروف خاصة مثل الضوء، كما أنه يدخل في صناعة السيراميك، بالإضافة إلى أنه يمكن إضافته إلى بعض المواد المعدنية حتى تزيد من صلابتها.
ما هي الفلزات ؟
الفلزات عي عبارة عن مواد جيدة التوصيل للحرارة والكهرباء، تتكيز بالليونة العالية، كما يوجد لديها العديد من القدرات التي تعمل على عكس الضوء، تعتبر الفلزات من العناصر الأكثر انتشاراً في الجدول الدول حيث إنها تشكل ثلاثة أرباع العناصر، تتواجد بكثرة في القشرة الأرضية، ومنها الألومنيوم، والحديد والكالسيوم، والصوديوم وغيره الكثير.
خصائص الفلزات
تتميز الفلزات أنها لديها القدرة على فقدان الإلكترونات وبالتالى تكون أيونات موجبة، بالإضافة إلى العديد من الخصائص ومنها ما يلي:
- تمتلك القدرة على فقدان الإلكترونات بسهولة.
- تتميز درجات انصهار عالية في أغلب العناصر.
- أغلب العناصر جيدة التوصيل للحرارة والكهرباء.
- تتميز بالليونة وقابلة للسحب والطرق والتشكيل.
- سهلة التعرض إلى الصدأ والتآكل بفعل هواء أو ماء البحر.
- لها بريق لامع.
ما هي اللافلزات ؟
اللافلزات هي عبارة عن مجموعة من العناصر الكيميائية التي تميل إلى اكتساب الإلكترونات، للوصول إلى حالة الاستقرار، وتتحول إلى أيونات سالبة الشحنة من خلال تكوين رابطة أيونية مع الفلزات، أو رابطة تساهمية مع لافلزات أخرى، تتواجد اللافلزات في أعلى الجانب الأيسر من الجدول الدوري، ما عدا الهيدروجين حيث يتواجد في أعلى الجانب الأيمن مع الفلزات القلوية وهو أول عناصر الجدول الدوري.
خصائص اللافلزات
اللافلزات لديها العديد من الخصائص والتى تتناقد تماماً مع خصائص الفلزات، ومن هذه الخصائص مايلي:
- أغلب العناصر تميل إلى اللون الأسود؛ لأنها ليس لديها بريق.
- حجمها الذري يكون صغيراً على عكس الفلزات.
- تتميز بالسالبية الكهربية المرتفعة.
- لها درجة انصهار منخفضة.
- غير جيدة في توصيل الحرارة والكهرباء.
- لا يوجد لها رنين.
- تتواجد في الحالة الغازية، ومن أمثلة العناصر التي تتواجد في تلك الحالة الأكسجين والهيدروجين والهيليوم والنيتروجين.
- يوجد بعض العناصر التي تتواجد في الحالة الصلبة مثل: الكبريت، والكربون، واليود.
- كما يتواجد بعض العناصر في الحالة السائلة، مثل: البرومين.
- تكون نشطة كيميائياً مثل: والبعض الآخر غير نشط مثل الهيليوم والنيون، والتي يطلق عليها الغازات النبيلة.
- يحتوي غلاف إلكترونات التكافؤ على أكثر من أربعة إلكترونات.
- تتفاعل مع الأكسجين، حتى تقوم بتكوين أكاسيد حمضية، ولا تتفاعل مع الأحماض المخففة.
كانت هذه ابرز المعلومات حول موضوع اشباه اللافلزات لها خواص فيزيائية وكيميائية مشابهة للفلزات فقط مقدمة لحضراتكم من موقع مشروع المعرفة .










